足部骨折
来源:74U閱讀網
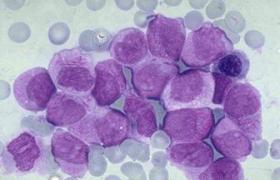
慢性粒細胞白血病
慢性粒細胞白血病百科
慢性髓性白血病(CML)是骨髓造血幹細胞克隆性增殖形成的惡性腫瘤,絕大多數患者緩慢起病,早期常無癥狀,臨床逐步出現乏力、食欲不振、腹部脹滿、盜汗和體重降低,偶因體檢發現白細胞計數增高或左上腹包塊而作進一步檢查.通常大多數CML患者臨床上處於“慢性”或“穩定”階段,此期可持續3~4年.常見的癥狀包括:貧血、脾區不適、出血及乏力、體重減輕和低熱等代謝增高的表現.部分患者無癥狀,因常規體檢發現白細胞數、血小板數增高或脾臟腫大而診斷.少數病人有痛風性小關節疼痛.此外,還有視力障礙、神經系統病變以及陰莖異常勃起等.慢性期患者不易感染,發熱少見.當疾病進展時,患者開始出現發熱、骨痛、脾大等現象,白細胞計數持續上升,骨髓或外周血中原始細胞增多等表現.臨床上可分為慢性期和加速期、急變期.
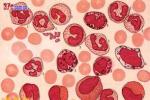
慢性粒細胞白血病
慢性粒細胞白血病病因
一、發病原因
1、離子輻射可以使CML發生率增高,在廣島和長崎原子彈爆炸後幸存者、接受脊椎放療的強直性脊椎炎患者和接受放療的宮頸癌患者中CML發病率與其他人群相比明顯增高.
2、長期接觸苯和接受化療的各種腫瘤患者可導致CML發生,提示某些化學物質亦與CML發關.
3、CML患者HLA抗原CW3和CW4頻率增高,表明其可能是CML的易感基因.
4、盡管有傢族性CML的報道,但CML傢族性聚集非常罕見,此外單合子雙胞胎的其他成員CML發病無增高趨勢,CML患者的父母及子女均無CML特征性Ph染色體,說明CML是一種獲得性白血病.
二、發病機制
1.起源於造血幹細胞 CML是一種起源於造血幹細胞的獲得性克隆性疾病,其主要證據有:
①CML慢性期可有紅細胞,中性粒細胞,嗜酸/嗜堿粒細胞,單核細胞和血小板增多;
②CML患者的紅系細胞,中性粒細胞,嗜酸/嗜堿粒細胞,巨噬細胞和巨核細胞均有Ph染色體;
③在G-6-PD雜合子女性CML患者中,紅細胞,中性粒細胞,嗜酸/嗜堿粒細胞,單核細胞和血小板表達同一種G-6-PD同工酶,而成纖維細胞或其他體細胞則可檢測到兩種G-6-PD同工酶;
④每個被分析的細胞其9或22號染色體結構異常都一致;
⑤分子生物學研究22號染色體斷裂點變異僅存在於不同CML患者,而在同一病人的不同細胞中其斷裂點是一致的;
⑥應用X-連鎖基因位點多態性及滅活式樣分析亦證實瞭CML為單克隆造血.
2.祖細胞功能異常 相對成熟的髓系祖細胞存在有明顯的細胞動力學異常,裂指數低,處於DNA合成期的細胞少,細胞周期延長,核漿發育不平衡,成熟粒細胞半衰期比正常粒細胞延長,采用3H自殺試驗證實僅隻有20%的CML集落處於DNA合成期,而正常人為40%,CML原粒,早幼粒細胞標記指數比正常人低,而中,晚幼粒細胞標記指數與正常對照相比無明顯差別,造血祖細胞集落培養發現CML骨髓祖細胞與外周血祖細胞的增殖能力不同,骨髓CFU-GM和BFU-E數與正常對照相比通常增高,但亦可正常或減低,而外周血可升高至正常對照的100倍,Ph陽性CML病人骨髓細胞長期培養研究發現,經幾周培養後在培養基中可檢測到Ph陰性的祖細胞,現已證實這主要為CML造血祖細胞黏附功能異常所致.
3.分子病理學 1960年,Nowell和Hungerfor描述瞭CML相關的Ph染色體,這是首次發現的與一特異人類腫瘤相關的非隨機染色體異常,1973年Rowley采用奎寧和姬姆薩染色技術首次證實CML中發現的Ph染色體(22q-異常)是t(9;22)(q34;q11)染色體易位所致,1982年在9q34斷裂區克隆出瞭ABL基因,1983年證實位於q34的基因片段易位到22號染色體上與22q11斷裂區一個稱為BCR的基因形成BCR-ABL融合基因.
(1)ABL基因:原癌基因c-abl定位於q34,在物種發育過程中高度保守,編碼在所有哺乳動物組織和各種類型細胞中均普遍表達的一個蛋白質,c-abl長約230kb,含有11個外顯子,走向為5′端至著絲粒,該基因第一個外顯子有兩種形式,外顯子1a和1b,因而有兩種不同的c-abl mRNA,第一種稱為1a-11,長6kb,包括外顯子1a-11;另一種稱為1b,自外顯子1b開始,跨越外顯子1a和第一個內含子,同外顯子2-11相接,長為6kb,這兩種ABL的RNA轉錄編碼兩種不同的分子量均為145000的ABL蛋白,DNA序列分析發現,c-abl屬非受體蛋白-酪氨酸激酶傢族,除激酶 片斷外,該基因還有在信號傳導蛋白的相互作用和調節中非常重要的SH2和SH3片斷,c-abl的特征是有一個大的C末端非催化片斷,該片斷含有DNA和細胞骨架結合的重要序列和一個參與該傳導信號的區域,正常的p145ABL穿梭於細胞核和胞漿之間,主要定位於細胞核,具有較低的酪氨酸激酶活性,p145ABL的活性和細胞內定位受連接細胞骨架與細胞外間質的整合素(integrins)調控,現有研究表明至少在纖維細胞,ABL激活需要細胞黏附,因此ABL可能通過將整合素信號傳遞至細胞核從而充當黏附和細胞周期信號之間的橋梁,參與細胞生長和分化控制.
(2)BCR基因:BCR基因定位於22q11,長130kb,有21個外顯子,起始方向5′端至中心粒,有4.5kb和6.7kb兩種不同的BCR mRNA轉錄方式,編碼一分子量為160000的蛋白p160 BCR,該蛋白有激酶活性,p160 BCR之C末端與ras相關的GTP結合蛋白p21的GTP活性有關聯.
(3)BCR-ABL基因:位於9q34的c-abl基因易位於22號染色體與位於22q11的bcr基因形成BCR-ABL融合基因,迄今CML患者中已發現有3個bcr斷裂點叢集區,分別為M-bcr,m-bcr,u-bcl和6種BCR-ABL融合轉錄方式,與M-bcr相應的有b2a2,b3a2,b2a3,其編碼蛋白為p210,與m-bcr相應的有ela2,其編碼蛋白為p190,與u-bcr相應的有e19a2,其編碼蛋白為p230.
小鼠模型體內已證實BCR-ABL可導致CML發生,BCR-ABL融合蛋白定位於細胞漿,具有極高的酪氨酸激酶活性,通過改變作為BCR-ABL催化底物的一些關鍵的調節蛋白磷酸化狀況激活多種信號傳導途徑,如通過激活參與細胞增殖和分化調控的Ras信號途徑,使祖細胞數量增多,幹細胞池減少,幹細胞成為增殖池的一部分,從而使未成熟粒細胞不斷擴增,BCR-ABL作用的另一種機制是改變正常整合素功能,正常造血祖細胞黏附於細胞外基質,而黏附是由祖細胞細胞表面受體特別是整合素來介導的,BCR-ABL通過幹擾β1整合素的功能導致CML細胞的細胞黏附功能缺陷,從而使未成熟細胞釋放至外周血並遷移至髓外部位.
最近,CML發病機制研究又取得瞭進展:
①體外培養發現,BCR-ABL通過抑制凋亡而延長CML祖細胞的因子非依賴性生長時間;
②用反義寡核苷酸下調BCR-ABL表達後可能通過增加細胞對凋亡的敏感性從而抑制白血病細胞在小鼠體內生長,特別是減少CML病人早期祖細胞集落形成,降低CML樣細胞系的細胞增殖;
③表達BCR-ABL的,轉化的,因子非依賴性的,可致瘤的小鼠造血細胞通過上調bcl-2而增加對凋亡的敏感性,當bcl-2表達受抑後,BCR-ABL陽性細胞又變成瞭因子依賴性和非致瘤性,以上實驗結果表明,BCR-ABL抑制細胞凋亡導致髓系細胞不斷擴增是CML的又一發病機制.
(4)急變發生機制:細胞遺傳學研究發現80%的AP或BP CML患者有繼發性染色體異常,最常見的異常依次為+8,+Ph,i(17),+19,+21和-Y,急性粒細胞白血病變(急粒變)的患者中約80%有非隨機性染色體異常,其染色體核型常表現為超二倍體,最常見的異常為+8,且+8常與其他染色體異常如i(17),+Ph,+19等同時出現,其次為+Ph,i(17)和-Y,急性淋巴細胞白血病變(急淋變)的患者約30%有繼發性克隆性染色體異常,常為染色體丟失,從而表現為亞二倍體或結構異常,常見異常為+Ph和-Y,+8少見,i(17)尚未見報道,-7,14q+與急淋變特異相關,盡管有研究發現急變期CML有N-Ras基因突變和c-Myc基因表達增高,但其發生率極低,Rb基因在急變期CML患者亦極少有改變,Sill等發現p161NK4A基因的純合子缺失與CML急淋變相關,CML急性變分子機制研究較多的還是p53基因,20%~30%的急粒變的患者存在有p53基因結構和表達的異常,CMLp53基因改變特征為:①主要改變是基因重排和突變;②主要見於急粒變,急淋變極少見;③p53突變常見於有17P-異常患者;④p53突變能導致CML的急粒變,最近,又有鈣調素基因甲基化程度,端粒長度和端粒酶活性改變與CML急變關系的研究報道,但其意義尚待進一步闡明.
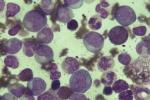
慢性粒細胞白血病
慢性粒細胞白血病癥狀
1.慢性期
(1)癥狀:通常大多數CML患者臨床上處於“慢性”或“穩定”階段,此期可持續3~4年,常見的癥狀包括:貧血,脾區不適,出血及乏力,體重減輕和低熱等代謝增高的表現,20%~40%的患者無癥狀,因常規體檢發現白細胞數,血小板數增高或脾臟腫大而診斷,少數病人有痛風性小關節疼痛,此外,還有視力障礙,神經系統病變以及陰莖異常勃起等,慢性期患者不易感染,發熱少見.
(2)體征:主要表現為臟器浸潤,90%患者脾臟腫大,程度不一,肋下可及至巨脾伸延至盆腔,質硬常有明顯切跡,脾栓塞時脾區可觸及摩擦感或聞及摩擦音,可有輕到中度肝臟腫大,淋巴結腫大少見,胸骨常有壓痛,以胸骨柄的下端為著,眼底視網膜浸潤,可見到視網膜血管迂回擴張,並可見呈片狀的出血斑以及白色浸潤中心.
2.急變期
慢性期經過數月或數年之後,惡性造血幹細胞極度增生,骨髓原粒+早幼粒細胞≥20%,可伴由血小板衍生生長因子過多引起的骨髓纖維化改變,每個病人何時急變尚不能預測,一旦發生急變,病情迅速惡化,治療非常困難,存活期很少超過6~12個月.
(1)癥狀:有不明原因的發熱,脾進一步腫大;出現骨痛,出血以及髓外腫物等浸潤現象,如淋巴結腫大,皮膚軟組織腫塊或溶骨性病變.
(2)急變類型:
①約65%為急粒變:包括:A.原始粒細胞危象,病情突然驟變,骨髓或血液中出現大量的原始粒細胞,原粒+早幼粒>90%,病情發展快,病程短,一般在1~2個月內死亡;B.慢粒急變,指CML經數周至數月的轉變過程,出現急性白血病的所有征象,骨髓中原始+早幼粒>20%,對治療耐藥,生存期不超過6個月.
②約30%為急淋變:包括普通型急性淋巴細胞白血病(C-ALL),非T非B淋巴細胞白血病,前B細胞白血病及B,T細胞白血病,急淋變經過長春新堿及潑尼松可獲暫時的緩解,但最終在0.5~1年內死亡.
③5%為其他少見類型的急髓變:包括組織細胞變,紅白血病變,巨核細胞變及急性單核細胞變,血象,骨髓象,細胞形態學等改變有其相應的特征,且預後差,絕大多數患者急變後6個月內死亡.
3.加速期
介於慢性期和急性期之間,此期臨床開始出現低熱,脾大等現象,貧血逐漸加重,白細胞持續上升,幼稚細胞開始增多,原粒+早幼粒≥10%,對原來有效的藥物出現耐藥,在數周或數月內即可演變成典型的急性期,染色體在此期已有變化如急性期,故染色體的改變早於血液學和臨床的轉變,可作為疾病進展及預後判斷的指標.
典型的CML伴有脾大,外周血白細胞數增高,可見各階段幼稚粒細胞,嗜酸和嗜堿粒細胞增高,骨髓增生明顯或極度活躍,以粒細胞系增生為主,中性晚幼及桿狀核粒細胞明顯增生,嗜酸和(或)嗜堿粒細胞亦增多,巨核細胞系常增生,中性粒細胞堿性磷酸酶積分(ALP)減低,細胞遺傳學檢查有Ph染色體或應用分子生物學方法檢測出BCR-ABL基因重排或融合,診斷並不困難.

慢性粒細胞白血病
慢性粒細胞白血病檢查
1.慢性期
(1)血象:白細胞數常>50×109/L有時可達500×109/L以上,約1/3患者血紅蛋白<110g/L,貧血多為正常細胞正色素性,血小板往往增多,有時高達1000×109/L,少數病人可正常減少,血塗片檢查中可見不同成熟階段的粒細胞,以中,晚幼粒細胞階段居多,原料細胞<5%,原粒+早幼粒細胞≤10%,嗜酸性及嗜堿性粒細胞增多,有少量有核紅細胞出現.
(2)骨髓象:增生極度活躍或明顯活躍,以粒系為著,粒與紅之比可增至10∶1~20∶1,粒系各階段均增加,以中,晚幼粒細胞增加為主,嗜酸性與嗜堿性粒細胞比例明顯高於正常,巨核細胞及血小板亦增多.
(3)中性粒胞堿性磷酸酶(ALP):染色積分減低或接近於零.
(4)細胞遺傳及分子生物學檢查:90%以上的慢性期患者骨髓中期分裂細胞往往Ph染色體陽性,分帶技術證明9號染色體長臂3區4帶與22號染色體1區1帶部分片段相互易位,即t(9;22)(q34;11),熒光素染色體原位雜交術(FISH)敏感性更高,提取骨髓或外周血單個核細胞的DNA,經DNA印跡法可檢測到bcr基因重排,發生在5端(b3a2),若提取骨髓或血單個核細胞部RNA,經反轉錄聚合酶鏈反應(RT-PCR)術可檢測到bcr/abl轉錄產物mRNA,是目前最靈敏而又特異的方法.
(5)血清生化測定:血清尿酸,乳酸脫氫酶及溶菌酶往往增高.
2.急變期
貧血迅速加重,骨髓及外周血中原始粒細胞明顯增多,骨髓原始粒細胞≥20%,如為急性危象則可達卡90%以上,血小板減少,中性分葉核細胞堿性磷酸酶可升高或正常,遺傳學檢查,常為非整倍體,除t(9;22)(q341;q11)的Ph染色體外,還附加其他染色體的異常,如出現第二個Ph染色體,或多一個8號染色體(+8),或者說17號染色體長臂等臂缺失(ISO17q-).
3.加速期
白細胞持續上升,幼稚細胞開始增多,原粒+早幼粒≥10%.
1.骨髓活檢病理切片銀染常示網狀纖維增生,約一半患者為顯著增生.
2.根據病情、癥狀、體征選擇做X線,CT,MRI,B超,心電圖等檢查.
慢性粒細胞白血病預防
避免或減少有害物質如放射性物質,化學物質,化學藥物的接觸.